La terapia genica si pone l’obiettivo di curare le malattie genetiche monofattoriali, cioè quelle causate da mutazioni all’interno di un singolo gene.
Le sequenze di basi nel DNA vengono “lette” in gruppi di tre (triplette o codoni) per ottenere le istruzioni per costruire le proteine, e ogni tripletta di basi corrisponde a un amminoacido. Qualsiasi alterazione all’interno della sequenza di DNA (mutazione) si ripercuote sulla sequenza di amminoacidi e quindi sulla funzione della proteina.
Anche mutazioni a carico di una singola base azotata possono avere conseguenze devastanti sulla proteina finale. Per esempio la sostituzione di una base con una differente può far cambiare l’amminoacido codificato da quella tripletta (mutazione missenso), mentre l’inserzione o la perdita (delezione) di una base fanno slittare la successione delle triplette causando la traduzione di una sequenza di amminoacidi totalmente diversa (mutazione frameshift).
In alcuni casi la sostituzione di una base può trasformare la tripletta originale in un codone di stop, ovvero una tripletta che indica la fine della proteina (mutazione non-senso), questo tipo di mutazioni causa una interruzione prematura della sequenza di amminoacidi dando vita a una proteina tronca che non sarà in grado di svolgere la sua funzione.
Talvolta la sostituzione di una base trasforma il codone iniziale in una tripletta che codifica per lo stesso amminoacido; mutazioni di questo tipo non hanno nessun effetto sulla sequenza amminoacidica della proteina e vengono dette mutazioni silenti.
Se a causa di una mutazione in un gene, la proteina che viene prodotta non è capace di svolgere correttamente la sua funzione, il risultato è una malattia. Per annullare gli effetti di mutazioni che interessano una singola proteina, si può fornire alle cellule una copia corretta del gene che la codifica.
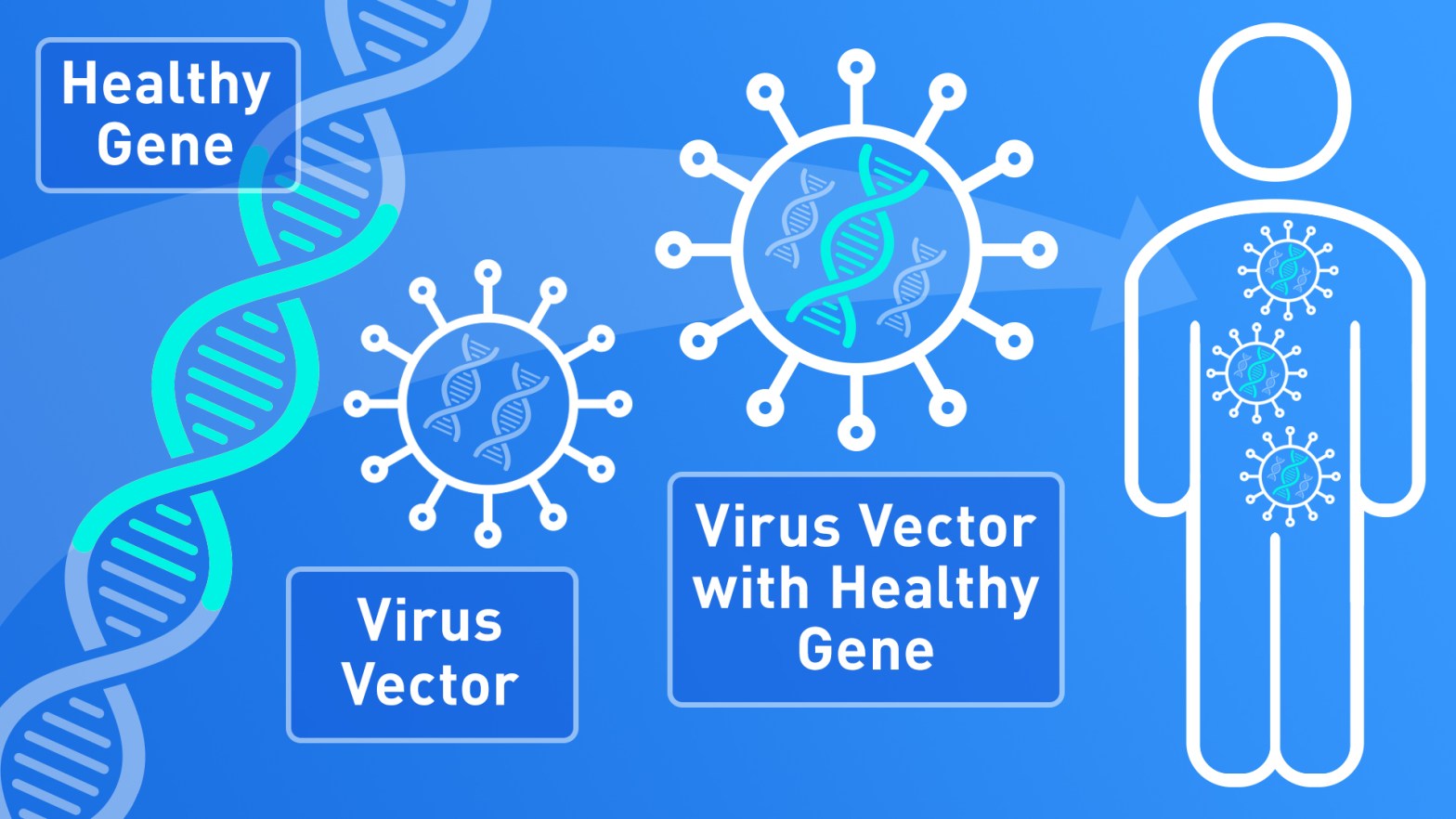
Per far arrivare un frammento di DNA alle cellule che ne hanno bisogno è necessario usare qualcosa che possa trasportarlo, un vettore. Spesso vengono usati vettori derivati da virus, in modo da sfruttarne la naturale capacità di entrare dentro le cellule e rilasciare materiale genetico.
Il tipo di vettore virale viene scelto in base alla facilità con cui il esso infetta il tipo di cellule in cui deve essere trasportata la copia corretta del gene (gene terapeutico). Infatti tutte le cellule di un organismo contengono tutto il DNA, ma ne usano solo una parte dell’informazione in esso contenuta (ciò rende una cellula muscolare diversa da una cellula nervosa o da una cellula renale).
I virus più importanti dal punto di vista clinico per la terapia genica sono i lentivirus, i retrovirus, gli adenovirus e i virus adeno-associati.
I virus vengono modificati (ingegnerizzati) per eliminarne la patogenicità, e i loro geni vengono sostituiti dal gene terapeutico e da altre sequenze di DNA necessarie per la sua corretta espressione.
La terapia genica può essere somministrata direttamente al paziente (in vivo), oppure il trattamento può essere eseguito su cellule (ex vivo) che verranno poi trasferite al paziente (in questo caso si parla di terapia genica cellulare).
Quando il vettore virale entra nella cellula che deve essere curata, esso rilascia il DNA terapeutico il quale sarà trascritto e tradotto per produrre la proteina mancante. Spesso non è possibile raggiungere tutte le cellule che hanno bisogno della proteina, nonostante ciò si considera che il trattamento ha avuto successo se la proteina è prodotta in quantità sufficiente da ridurre i sintomi della malattia e migliorare la qualità della vita dei pazienti.
Nel 2018 il prodotto di terapia genica Luxturna™ (AAV2-hRPE65v2) venne approvato sia in Europa che negli Stati Uniti per curare una forma di cecità progressiva ereditaria chiamata distrofia retinica, causata da una mutazione nel gene RPE65. La proteina RPE65 è un elemento del ciclo visivo, ed è necessaria per trasformare gli stimoli luminosi che colpiscono l’occhio in impulsi elettrici che vengono inviati al cervello per l’elaborazione delle immagini. Quando la luce arriva al nostro occhio, la molecola 11-cis retinale (una forma di vitamina A fotosensibile) viene trasformata in tutto-trans-retinale; questa conversione innesca una serie di reazioni chimiche che generano l’impulso elettrico.
La molecola tutto-trans-retinale però non è fotosensibile, quindi, affinché altri stimoli luminosi vengano convertiti in segnali elettrici e inviati al cervello, essa deve essere nuovamente convertita in 11-cis-retinale dalla proteina RPE65.
(Avete presente quando dopo essere stati colpiti dal faro di un’auto per qualche secondo vedete tutto scuro? È dovuto al fatto che un’enorme quantità di luce ha colpito i vostri occhi e RPE65 ha bisogno di un po’ di tempo per riconvertire tutte le molecole di tutto-trans in 11-cis-retinale).
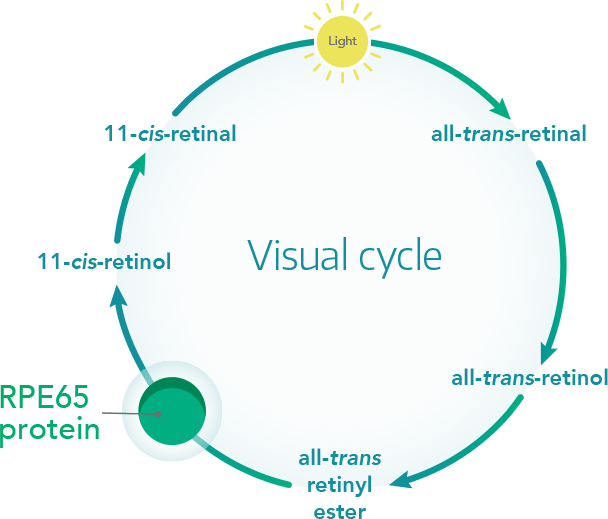
Nel caso di Luxturna™ una copia corretta del gene RPE65 viene trasportato da un vettore derivato da un virus adeno-associato (AVV2) con una particolare affinità per le cellule fotorecettrici umane. Il virus viene iniettato con una singola iniezione nella parte posteriore dell’occhio (in vivo), entra nelle cellule dell’epitelio retinico pigmentato, e rilascia il DNA che viene usato dalle cellule per produrre la proteina RPE65 funzionante.
Risultati promettenti sono stati ottenuti anche nel caso della β-talassemia.
La β-talassemia è dovuta a mutazioni nel gene della β-globina, che causano la riduzione o la totale assenza di emoglobina, la proteina con cui i globuli rossi trasportano l’ossigeno. I pazienti hanno quindi bisogno di frequenti trasfusioni di sangue durante l’intero corso della loro vita.
Nel 2017 è stato iniziato uno studio clinico per un trattamento di terapia genica cellulare su pazienti adulti e in età pediatrica. Le cellule del sangue dei pazienti sono state prelevate e infettate con un vettore derivato da un lentivirus in cui era stato inserito il gene della β-globina (ex vivo). Dopo il trattamento le cellule sono state reinserite nel midollo osseo degli stessi pazienti.
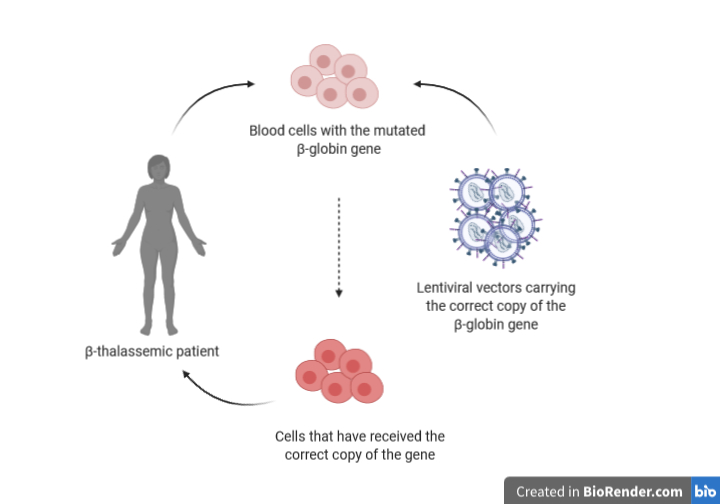
Questa terapia ha ridotto la frequenza delle trasfusioni in 6 pazienti su 7, che sono riusciti a produrre livelli di emoglobina sufficienti e stabili per un lungo periodo di tempo.
Numerosi studi preclinici e clinici per la terapia genica di molte altre malattie sono attualmente in corso.
Lasciate un commento se volete saperne di più sulla terapia genica o sui vettori virali!
Infografica della FDA, autore Michael J. Ermarth
Bibliografia:
Lista dei prodotti di terapia genica e cellulare approvati negli Stati Uniti: https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/approved-cellular-and-gene-therapy-products
Definizione di terapia genica e altri termini utili:
https://www.fda.gov/consumers/consumer-updates/what-gene-therapy-how-does-it-work
https://www.esgct.eu/Useful-Information/Gene-and-cell-therapy-glossary.aspx
https://ghr.nlm.nih.gov/primer/therapy/procedures
https://ghr.nlm.nih.gov/primer/therapy/genetherapy
Storia della terapia genica:
https://www.telethon.it/en/what-we-do/terapie-e-diagnosi/terapie-avanzate/gene-therapy
https://learn.genetics.utah.edu/content/genetherapy/success/
Luxturna™:
https://www.ema.europa.eu/en/medicines/human/EPAR/luxturna
https://luxturnahcp.com/how-LUXTURNA-works/mechanism-of-action/
Terapia genica per la beta-talassemia:
Intrabone hematopoietic stem cell gene therapy for adult and pediatric patients affected by transfusion-dependent ß-thalassemia, Marktel S. et al., Nature Medicine 2019, https://doi.org/10.1038/s41591-018-0301-6
2 thoughts on “I virus come alleati: la terapia genica per la distrofia retinica e la beta-talassemia.”